Categorias: Artigos em destaque » Eletricistas iniciantes
Número de visualizações: 36288
Comentários sobre o artigo: 1
Fontes de corrente química: principais características
 Por mais de dois séculos, a humanidade tem usado a energia de reações químicas entre várias substâncias para produzir corrente direta.
Por mais de dois séculos, a humanidade tem usado a energia de reações químicas entre várias substâncias para produzir corrente direta.
Princípio de funcionamento
A reação redox que ocorre entre substâncias com as propriedades de um agente oxidante e um agente redutor é acompanhada pela liberação de elétrons, cujo movimento forma uma corrente elétrica. No entanto, para usar sua energia, é necessário criar condições para a passagem de elétrons através de um circuito externo; caso contrário, ele é liberado pelo calor a partir de uma simples mistura de um agente oxidante e um agente redutor.
Portanto, todas as fontes de corrente química possuem dois eletrodos:
-
o ânodo no qual a oxidação ocorre;
-
cátodo, realizando a restauração da substância.
Eletrodos à distância são colocados em um vaso com um eletrólito - uma substância que conduz corrente elétrica devido aos processos de dissociação do meio em íons.
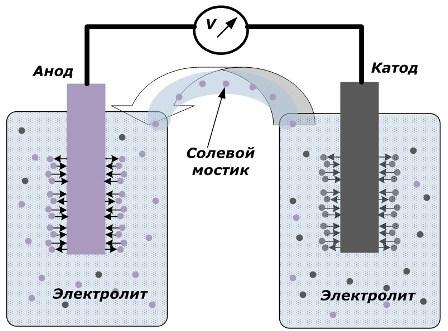
O princípio de converter energia química em energia elétrica
A figura mostra que os eletrodos são colocados em vasos separados, conectados por uma ponte de sal através da qual é criado o movimento de íons ao longo do circuito interno. Quando os circuitos externos e internos estão abertos, ocorrem dois processos nos eletrodos: a transição de íons do metal do eletrodo para o eletrólito e a transição de íons do eletrólito para a rede cristalina dos eletrodos.
As taxas de fluxo desses processos são as mesmas e os potenciais de tensão de sinais opostos são acumulados em cada eletrodo. Se eles estiverem conectados através de uma ponte de sal e uma carga for aplicada, um circuito elétrico ocorrerá. Uma corrente interna é gerada pelo movimento de íons entre os eletrodos através do eletrólito e da ponte de sal. O movimento dos elétrons ao longo do circuito externo do ânodo para o cátodo ocorre.
Quase todas as reações redox são acompanhadas pela geração de eletricidade. Mas seu valor depende de muitos fatores, incluindo os volumes e massas dos produtos químicos utilizados, os materiais usados para fabricar os eletrodos, como eletrólito, concentração de íons e design.
Os mais amplamente utilizados nas fontes de corrente químicas modernas são:
-
para o material do ânodo (agente redutor), zinco (Zn), chumbo (Pb), cádmio (Cd) e alguns outros metais;
-
para o material do cátodo (oxidante) - óxido de chumbo PbO2, óxido de manganês MnO2, hidróxido de níquel NiOOH e outros;
-
eletrólitos à base de soluções de ácidos, álcalis ou sais.
Métodos de classificação
Uma parte das fontes de energia química pode ser reutilizada, enquanto a outra não. Este princípio é tomado como base para sua classificação.
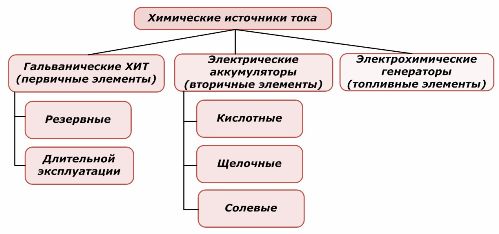
Classificação de elementos químicos
Força eletromotriz células galvânicas, dependendo do design, atinge 1,2 ÷ 1,5 volts. Para obter grandes valores, eles são combinados em baterias, conectando em série. Quando as baterias são conectadas em paralelo, a corrente e a potência aumentam.
É geralmente aceito que fontes de corrente química primária não suportam recarga, embora mais precisamente essa posição possa ser formulada de maneira diferente: sua implementação não é economicamente viável.
Fontes redundantes de corrente química primária são armazenadas em um estado em que o eletrólito é isolado dos eletrodos. Isso elimina a ocorrência da reação redox e garante a disponibilidade para o comissionamento. Eles não são reutilizados. O prazo de validade das fontes de energia de backup de produtos químicos é limitado a 10 a 15 anos.
As baterias são recarregadas com sucesso pela aplicação de energia elétrica externa. Devido a esse recurso, eles são chamados de fontes de corrente secundárias. Eles são capazes de suportar centenas e milhares de ciclos de descarga de carga.O EMF da bateria pode estar na faixa de 1,0 ÷ 1,5 volts. Eles também são combinados em baterias.
Os geradores eletroquímicos trabalham com o princípio das células galvânicas, mas transportam substâncias de fora para conduzir uma reação eletroquímica e todos os produtos liberados são removidos do eletrólito. Isso permite que você organize um processo contínuo.
Principais características de desempenho de fontes de energia química
1. A voltagem nos terminais abertos
Dependendo do design, uma única fonte pode criar apenas uma certa diferença de potencial. Para uso em dispositivos elétricos, eles são combinados em baterias.
2. Capacidade específica
Durante um certo período de tempo (em horas), uma fonte de corrente química pode gerar uma quantidade limitada de corrente (em amperes), atribuída a uma unidade de peso ou volume.
3. Densidade de potência
Caracteriza a capacidade de uma unidade de peso ou volume de uma fonte de corrente química de gerar energia gerada pelo produto da tensão pela força da corrente.
4. Duração da operação
Este parâmetro também é chamado de data de validade.
5. O valor das correntes de descarga automática
Esses processos secundários de reações eletroquímicas levam ao consumo da massa ativa dos elementos, causam corrosão e reduzem a capacidade específica.
6. preço do produto
Depende do design, dos materiais utilizados e de vários outros fatores.
As melhores fontes de corrente química são aquelas com altos valores dos quatro primeiros parâmetros, e a autodescarga e o custo são baixos.
Princípios de carga da bateria
Entre as fontes de corrente químicas secundárias, elas estão ganhando grande popularidade. modelos de íons de lítio, que se tornaram amplamente utilizados para alimentar dispositivos eletrônicos. Eles usam LiMO2 (M Co, Ni, Mn) como material do eletrodo positivo e grafite como eletrodo negativo.
Quando carregados, íons de lítio da energia externa aplicada são liberados do metal do cátodo, passam pelo eletrólito e penetram no espaço entre as camadas de grafite, acumulando-se ali.
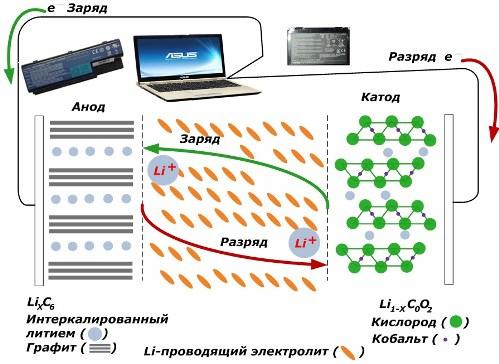
Quando a energia carregador estiver ausente e a carga estiver conectada aos eletrodos, os íons de lítio no eletrólito se movem na direção oposta.
Se a carga e a descarga não forem realizadas, a energia na bateria não é consumida, mas armazenada. Mas sua quantidade é limitada pelas propriedades dos materiais utilizados. Por exemplo, nas baterias de íons de lítio, a capacidade elétrica específica é de 130 × 150 mAh / g. É limitado pelas propriedades do material do ânodo. Para grafite, a capacidade é cerca de duas vezes maior.
Os cientistas agora estão procurando maneiras de aumentar a capacidade da bateria, estão explorando a possibilidade de usar uma reação química entre o lítio e o oxigênio no ar. Para isso, os projetos são desenvolvidos com um cátodo não descartável, usado em baterias separadas. Este método pode aumentar a densidade de energia em até 10 vezes.
A operação de fontes de corrente química requer conhecimento fundamentos da engenharia elétrica, eletroquímica, ciência dos materiais e física do estado sólido.
Veja também em bgv.electricianexp.com
:
