Categorias: Artigos em destaque » Eletricistas iniciantes
Número de visualizações: 70526
Comentários sobre o artigo: 0
Células galvânicas - dispositivo, princípio de operação, tipos e principais características
Pré-requisitos para o aparecimento de células galvânicas. Um pouco de história. Em 1786, o professor de medicina italiano, o fisiologista Luigi Aloisio Galvani descobriu um fenômeno interessante: os músculos das patas traseiras de um cadáver recém-aberto de um sapo, suspenso em ganchos de cobre, se contraíram quando o cientista os tocou com um bisturi de aço. Galvani concluiu imediatamente que isso era uma manifestação de "eletricidade animal".
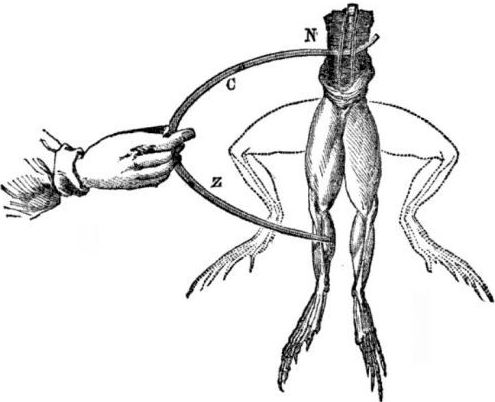
Após a morte de Galvani, seu contemporâneo Alessandro Volta, como químico e físico, descreverá e demonstrará publicamente um mecanismo mais realista para a ocorrência de corrente elétrica quando diferentes metais entrarem em contato.
Volta, após uma série de experimentos, chegará à conclusão inequívoca de que a corrente aparece no circuito devido à presença nele de dois condutores de metais diferentes colocados em um líquido, e isso não é de todo a “eletricidade animal”, como Galvani pensava. A contração das pernas do sapo foi consequência da ação da corrente decorrente do contato de vários metais (ganchos de cobre e bisturi de aço).
Volta mostrará o mesmo fenômeno que Galvani mostrou em um sapo morto, mas em um eletrômetro caseiro completamente inanimado, e em 1800 dará uma explicação precisa da corrente: “o condutor de segunda classe (líquido) está no meio e está em contato com dois condutores de primeira classe de dois diferentes metais ... Como resultado disso, surge uma corrente elétrica de uma direção ou de outra. "

Em um dos primeiros experimentos, Volta baixou duas placas - zinco e cobre - em um pote de ácido e as conectou com arame. Depois disso, a placa de zinco começou a se dissolver e formaram bolhas de gás no aço de cobre. Volta sugeriu e provou que a corrente elétrica flui através do fio.
Assim foi inventado o "elemento Volta" - a primeira célula galvânica. Por conveniência, Volta deu a ele a forma de um cilindro vertical (pilar), consistindo de anéis interligados de zinco, cobre e tecido impregnado de ácido. Um polo de volt com meio metro de altura criou uma voltagem sensível aos seres humanos.
Desde o início da pesquisa, foi estabelecido por Luigi Galvani, o nome fonte de corrente química preservou a memória dele em seu nome.
Célula galvânica É uma fonte química de corrente elétrica, baseada na interação de dois metais e / ou seus óxidos em um eletrólito, levando ao aparecimento de uma corrente elétrica em um circuito fechado. Assim, nas células galvânicas, a energia química é convertida em energia elétrica.
Células Hoje

As células hoje são chamadas de baterias. Três tipos de baterias são comuns: solução salina (seca), alcalina (também chamada de alcalina, "alcalina" na tradução para o inglês - "alcalina") e lítio. O princípio de seu trabalho é o mesmo descrito por Volta em 1800: dois metais interagir através de eletrólito, e uma corrente elétrica surge em um circuito fechado externo.
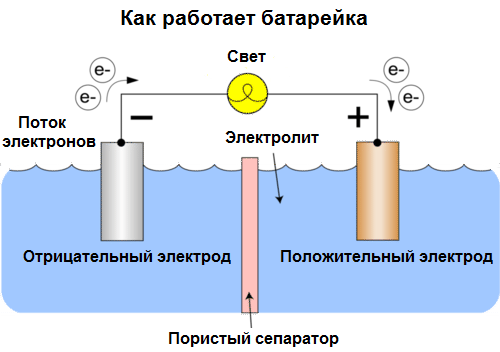
A voltagem da bateria depende dos metais utilizados e do número de células na "bateria". As baterias, diferentemente das baterias, não são capazes de restaurar suas propriedades, pois convertem diretamente a energia química, ou seja, a energia dos reagentes (redutor e oxidante) que compõem a bateria em energia elétrica.
Os reagentes incluídos na bateria são consumidos durante a operação, a corrente diminui gradualmente; portanto, a ação da fonte termina após a reação completa dos reagentes.
Elementos alcalinos e salgados (baterias) são amplamente utilizados para alimentar uma variedade de dispositivos eletrônicos, equipamentos de rádio, brinquedos e lítio, podendo ser encontrados com mais frequência em dispositivos médicos portáteis, como medidores de glicose no sangue ou em tecnologia digital, como câmeras.

Baterias de sal
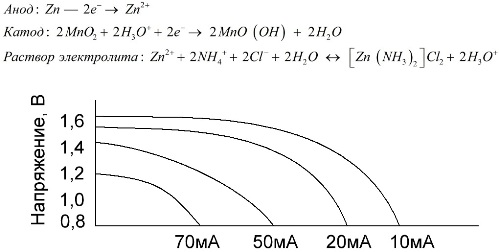
As células de manganês-zinco, chamadas de baterias de sal, são células galvânicas "secas", nas quais não existe solução eletrolítica líquida.
Um eletrodo de zinco (+) é um cátodo em forma de copo e uma mistura em pó de dióxido de manganês e grafite serve como ânodo. A corrente flui através de uma haste de grafite. Como eletrólito, uma pasta é usada a partir de uma solução de cloreto de amônio com a adição de amido ou farinha para engrossar, para que nada flua.
Normalmente, os fabricantes de baterias não indicam a composição exata dos elementos de sal; no entanto, as baterias de sal são as mais baratas, geralmente são usadas em dispositivos onde o consumo de energia é extremamente baixo: em horas, em controles remotos, em termômetros eletrônicos, etc.

O conceito de "capacidade nominal" raramente é usado para caracterizar as baterias de manganês-zinco, uma vez que sua capacidade é altamente dependente das condições e condições operacionais. As principais desvantagens desses elementos são uma taxa significativa de redução de tensão durante toda a descarga e uma diminuição significativa na capacitância de saída com o aumento da corrente de descarga. A tensão de descarga final é ajustada dependendo da carga na faixa de 0,7-1,0 V.
É importante não apenas a magnitude da corrente de descarga, mas também o cronograma da carga. Com descargas intermitentes de correntes grandes e médias, o desempenho das baterias aumenta acentuadamente em comparação com a operação contínua. No entanto, com pequenas correntes de descarga e meses de interrupções na operação, sua capacitância pode diminuir como resultado da auto-descarga.
O gráfico acima mostra as curvas de descarga de uma bateria média de sal por 4, 10, 20 e 40 horas para comparação com uma bateria alcalina, que será discutida mais adiante.
Pilhas alcalinas (alcalinas)
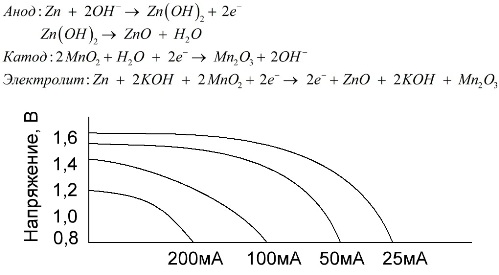
Uma bateria alcalina é uma bateria galvânica de manganês-zinco, na qual o dióxido de manganês é usado como cátodo, o zinco em pó é usado como ânodo e uma solução alcalina é usada como eletrólito, geralmente na forma de uma pasta de hidróxido de potássio.
Essas baterias têm várias vantagens (em particular, uma capacidade significativamente maior, melhor desempenho em baixas temperaturas e altas correntes de carga).

As baterias alcalinas, em comparação com a solução salina, podem fornecer mais corrente por um longo tempo. Uma corrente maior se torna possível porque o zinco é usado aqui não na forma de um vidro, mas na forma de um pó com uma maior área de contato com o eletrólito. O hidróxido de potássio na forma de uma pasta é usado como eletrólito.
É graças à capacidade desse tipo de célula galvânica de fornecer uma corrente significativa (até 1 A) por um longo tempo, as baterias alcalinas são as mais comuns atualmente.
Em brinquedos elétricos, em equipamentos médicos portáteis, em dispositivos eletrônicos, em câmeras, pilhas alcalinas são usadas em todos os lugares. Servem 1,5 vezes mais que a solução salina se a descarga for de baixa corrente. O gráfico mostra as curvas de descarga em diferentes correntes para comparação com uma bateria de sal (o gráfico foi dado acima) por 4, 10, 20 e 40 horas.
Baterias de lítio
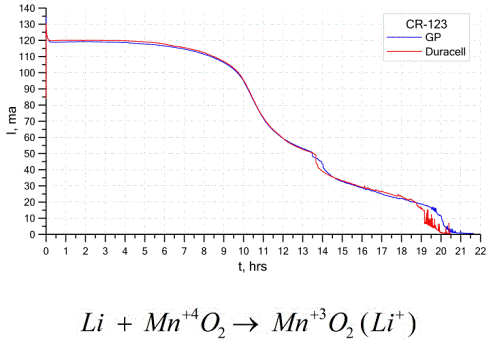
Outro tipo bastante comum de células galvânicas são as baterias de lítio - células galvânicas não recarregáveis únicas nas quais o lítio ou seus compostos são usados como ânodo. Devido ao uso de metal alcalino, eles apresentam uma grande diferença de potencial.

O cátodo e o eletrólito de uma célula de lítio podem ser muito diferentes; portanto, o termo "célula de lítio" combina um grupo de células com o mesmo material anódico.Como cátodo, por exemplo, pode ser usado dióxido de manganês, monofluoreto de carbono, pirita, cloreto de tionil etc.
As baterias de lítio são diferenciadas das outras por seu alto tempo de execução e alto custo. Dependendo do tamanho selecionado e dos materiais químicos utilizados, uma bateria de lítio pode produzir voltagens de 1,5 V (compatível com baterias alcalinas) a 3,7 V.
Essas baterias têm a maior capacidade por unidade de massa e longa vida útil. As células de lítio são amplamente utilizadas em modernos equipamentos eletrônicos portáteis: para alimentar relógios em placas-mãe de computadores, para alimentar dispositivos médicos portáteis, relógios, calculadoras, em equipamentos fotográficos, etc.
O gráfico acima mostra as curvas de descarga para duas baterias de lítio de dois fabricantes populares. A corrente inicial foi de 120 mA (por resistor da ordem de 24 Ohms).
Veja também: Pilhas recarregáveis modernas - vantagens e desvantagens
Veja também em bgv.electricianexp.com
: