Categorias: Eletricistas iniciantes, Eletricista industrial
Número de visualizações: 37528
Comentários sobre o artigo: 0
A aplicação prática da eletrólise
Quando uma corrente elétrica passa por uma solução ou um derretimento de um eletrólito, eletrodos dissolvidos ou outras substâncias que são produtos de reações secundárias nos eletrodos são liberados nos eletrodos. Esse processo físico-químico é chamado de eletrólise.
A essência da eletrólise
No campo elétrico criado pelos eletrodos, os íons no fluido condutor vêm em um movimento ordenado. O eletrodo negativo é o cátodo, o positivo é o ânodo.
Os íons negativos chamados ânions (íons do grupo hidroxila e resíduos ácidos) correm para o ânodo e os íons positivos chamados cátions (hidrogênio, metal, íons de amônio, etc.) correm para o cátodo
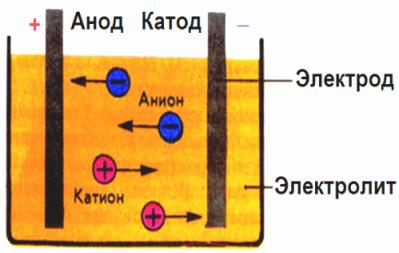
Um processo de redução da oxidação ocorre nos eletrodos: a redução eletroquímica de partículas (átomos, moléculas, cátions) ocorre no cátodo e a oxidação eletroquímica de partículas (átomos, moléculas, ânions) ocorre no ânodo. As reações de dissociação em um eletrólito são reações primárias, e as reações que prosseguem diretamente nos eletrodos são chamadas secundárias.
As leis da eletrólise de Faraday
A separação das reações de eletrólise em primária e secundária ajudou Michael Faraday a estabelecer as leis da eletrólise:
-
A primeira lei da eletrólise de Faraday: a massa da substância depositada no eletrodo durante a eletrólise é diretamente proporcional à quantidade de eletricidade transferida para esse eletrodo. Por quantidade de eletricidade entende-se uma carga elétrica, medida, em regra, em pingentes.
-
A segunda lei da eletrólise de Faraday: para uma determinada quantidade de eletricidade (carga elétrica), a massa de um elemento químico depositado no eletrodo é diretamente proporcional à massa equivalente do elemento. A massa equivalente de uma substância é a sua massa molar dividida por um número inteiro, dependendo da reação química em que a substância está envolvida.
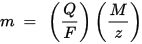
m é a massa da substância depositada no eletrodo, Q é a carga elétrica total que passa pela substância F = 96.485,33 (83) C mol - 1 é a constante de Faraday, M é a massa molar da substância (por exemplo, a massa molar da água H2O = 18 g / mol), z é o número de valência de íons de uma substância (o número de elétrons por íon).
Observe que M / z é a massa equivalente da substância precipitada. Para a primeira lei de Faraday, M, F e z são constantes; portanto, quanto maior o valor de Q, maior o valor de m. Para a segunda lei de Faraday, Q, F e z são constantes; portanto, quanto maior o valor de M / z (massa equivalente), maior o valor de m.
Hoje, a eletrólise é amplamente utilizada na indústria e na tecnologia. Por exemplo, é a eletrólise que serve como um dos métodos mais eficientes para a produção industrial de hidrogênio, peróxido de hidrogênio, dióxido de manganês, alumínio, sódio, magnésio, cálcio e outras substâncias. A eletrólise é usada para tratar águas residuais, galvanoplastia, galvanoplastia e, finalmente, em fontes de corrente química. Mas as primeiras coisas primeiro.
Obtenção de metais puros a partir de minérios por eletrólise
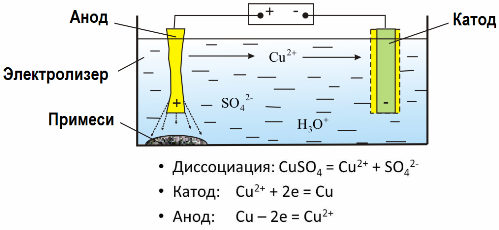
Graças à eletrólise, muitos metais são extraídos dos minérios e submetidos a processamento adicional. Assim, quando o minério ou minério enriquecido - concentrado - é tratado com reagentes, o metal passa para a solução e, em seguida, o metal é extraído da solução por eletroextração. O metal puro é liberado ao mesmo tempo no cátodo. Desta forma, recebem zinco, cobre, cádmio.
Os metais são submetidos a refino elétrico para eliminar impurezas e converter as impurezas contidas em uma forma conveniente para processamento adicional. O metal a ser limpo é fundido na forma de placas, e essas placas são usadas como ânodos na eletrólise.
Quando a corrente passa, o metal do ânodo se dissolve, passa na forma de cátions para a solução, então os cátions são descarregados no cátodo e formam um precipitado de metal puro. As impurezas do ânodo não se dissolvem - elas precipitam com a pasta do ânodo ou passam para o eletrólito, de onde são removidas contínua ou periodicamente.
Considere como um exemplo eletrorefinação de cobre. O principal componente da solução - sulfato de cobre - o sal mais comum e mais barato desse metal. A solução tem uma baixa condutividade elétrica. Para aumentá-lo, ácido sulfúrico é adicionado ao eletrólito.
Além disso, pequenas quantidades de aditivos são introduzidas na solução para facilitar a formação de um precipitado de metal compacto. Em geral, cobre, níquel, chumbo, estanho, prata e ouro são submetidos a refino eletrolítico.
Tratamento de águas residuais por eletrólise
A eletrólise é usada no tratamento de águas residuais (processos de eletrocoagulação, eletroextração e eletroflotação). O método de limpeza eletroquímico é um dos mais usados. Para eletrólise, são utilizados ânodos insolúveis (magnetita, óxido de chumbo, grafite, manganês, depositados sobre uma base de titânio) ou solúveis (alumínio, ferro).
Este método é usado para isolar substâncias orgânicas e inorgânicas tóxicas da água. Por exemplo, os tubos de cobre são limpos em escala com uma solução de ácido sulfúrico e as águas residuais industriais devem ser limpas por eletrólise com um ânodo insolúvel. O cobre é liberado no cátodo, que pode ser novamente utilizado na mesma empresa.
As águas residuais alcalinas são purificadas por eletrólise a partir de compostos de cianeto. A fim de acelerar a oxidação dos cianetos, aumentar a condutividade elétrica e economizar energia, um aditivo na forma de cloreto de sódio é usado na água.
A eletrólise é realizada com um ânodo de grafite e um cátodo de aço. Os cianetos são destruídos durante a oxidação eletroquímica e o cloro, que é liberado no ânodo. A eficácia dessa limpeza é próxima de 100%.
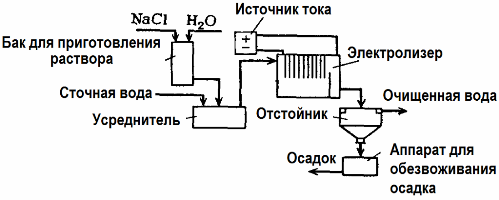
Além da limpeza eletroquímica direta, ele pode ser incluído no processo de eletrólise coagulação. Excluindo a adição de sais, a eletrólise é realizada com ânodos solúveis de alumínio ou ferro. Então, não apenas os contaminantes do ânodo são destruídos, mas o próprio ânodo se dissolve. Formam-se compostos dispersos ativos que coagulam (engrossam) contaminantes dispersos coloidais.
Este método é eficaz no tratamento de águas residuais de gorduras, derivados de petróleo, corantes, óleos, substâncias radioativas, etc. É chamado de eletrocoagulação.
Galvanoplastia
A galvanoplastia é a deposição eletrolítica de certos metais, a fim de proteger os produtos da corrosão e proporcionar uma aparência estética adequada (o revestimento é feito com cromo, níquel, prata, ouro, platina, etc.). A coisa é completamente limpa, desengordurada e usada como cátodo em um banho eletrolítico no qual é derramada uma solução salina do metal com o qual é necessário revestir o produto.
Uma placa do mesmo metal é usada como ânodo. Como regra, um par de placas de ânodo é usado e o objeto a ser galvanizado é colocado entre elas.
Eletroformação
Galvanoplastia - a deposição de metal na superfície de diferentes corpos para reproduzir suas formas: moldes para fundição de peças, esculturas, clichês impressos etc.

A deposição galvânica de metal na superfície de um objeto só é possível quando essa superfície ou todo o objeto é um condutor de corrente elétrica; portanto, é aconselhável usar metais para criar modelos ou formas. Os metais fusíveis são os mais adequados para esse fim: chumbo, estanho, solda, liga de madeira.
Estes metais são macios, facilmente processados com ferramentas para metais, são bem gravados e fundidos. Após a construção da camada galvânica e o acabamento, o metal do molde é fundido a partir do produto acabado.
No entanto, as maiores oportunidades para a fabricação de modelos ainda são representadas por materiais dielétricos. Para metalizar esses modelos, é necessário fornecer condutividade elétrica de superfície. O sucesso ou o fracasso, em última análise, depende principalmente da qualidade da camada condutora. Essa camada pode ser aplicada de uma de três maneiras.
A maneira mais comum é grafitação, é adequado para modelos de plasticina e outros materiais que permitem moer grafite na superfície.
O próximo truque é bronzeamento, o método é bom para modelos de forma relativamente complexa, para diferentes materiais; no entanto, devido à espessura da camada de bronze, a transferência de peças pequenas é um pouco distorcida.
E finalmente prateadoadequado em todos os casos, mas especialmente indispensável para modelos frágeis com uma forma muito complexa - plantas, insetos etc.
Fontes de corrente química
Além disso, a eletrólise é o principal processo pelo qual as fontes de corrente química mais avançadas, como baterias e acumuladores, funcionam. Existem dois eletrodos em contato com o eletrólito.
Uma diferença de potencial é estabelecida entre os eletrodos - uma força eletromotriz correspondente à energia livre da reação redox. Veja aqui para mais detalhes: Fontes químicas de corrente elétrica
Bateria de limão (clique na imagem para ampliar)
A ação das fontes de corrente química baseia-se na ocorrência de processos espacialmente separados com um circuito externo fechado: no ânodo negativo, o agente redutor é oxidado, os elétrons livres formados passam pelo circuito externo para o cátodo positivo, criando uma corrente de descarga, onde participam da reação de redução da oxidação. Assim, o fluxo de elétrons carregados negativamente ao longo do circuito externo vai do ânodo para o cátodo, ou seja, do eletrodo negativo para o positivo.
Veja também em bgv.electricianexp.com
: