Categorias: Artigos em destaque » Eletricistas iniciantes
Número de visualizações: 52646
Comentários sobre o artigo: 4
Transistores Parte 2. Condutores, isoladores e semicondutores
Início do artigo: História do transistor, Transistores: finalidade, dispositivo e princípios de operação
 Na engenharia elétrica, vários materiais são usados. As propriedades elétricas das substâncias são determinadas pelo número de elétrons na órbita da valência externa. Quanto menos elétrons estiverem nessa órbita, quanto mais fracos estiverem associados ao núcleo, mais fácil eles poderão viajar.
Na engenharia elétrica, vários materiais são usados. As propriedades elétricas das substâncias são determinadas pelo número de elétrons na órbita da valência externa. Quanto menos elétrons estiverem nessa órbita, quanto mais fracos estiverem associados ao núcleo, mais fácil eles poderão viajar.
Sob a influência de flutuações de temperatura, os elétrons se separam do átomo e se movem no espaço interatômico. Esses elétrons são chamados livres e criam uma corrente elétrica nos condutores. Existe um grande espaço interatômico, existe espaço para que elétrons livres viajem dentro da matéria?
A estrutura de sólidos e líquidos parece contínua e densa, remanescente na estrutura de uma bola de fio. Mas, de fato, até os sólidos são mais como uma rede de pesca ou voleibol. Obviamente, isso não pode ser discernido no nível doméstico, mas foi estabelecido por estudos científicos precisos que as distâncias entre os elétrons e o núcleo dos átomos são muito maiores que suas próprias dimensões.
Se o tamanho do núcleo atômico for apresentado na forma de uma bola do tamanho de uma bola de futebol, os elétrons neste modelo terão o tamanho de uma ervilha, e cada uma dessas ervilhas estará localizada do "núcleo" a uma distância de várias centenas e até milhares de metros. E entre o núcleo e o elétron está o vazio - simplesmente não há nada! Se imaginarmos as distâncias entre os átomos da matéria na mesma escala, as dimensões serão fantásticas - dezenas e centenas de quilômetros!
Bons condutores de eletricidade são metais. Por exemplo, os átomos de ouro e prata têm apenas um elétron na órbita externa, portanto, eles são os melhores condutores. O ferro também conduz eletricidade, mas é um pouco pior.
Conduzir eletricidade ainda pior ligas de alta resistência. Estes são nicromo, manganina, constantan, fechral e outros. Essa variedade de ligas de alta resistência se deve ao fato de serem projetadas para resolver vários problemas: elementos de aquecimento, extensômetros, resistores de referência para instrumentos de medição e muito mais.
Para avaliar a capacidade de um material conduzir eletricidade, o conceito de "Condutividade elétrica". O valor de retorno é resistividade. Na mecânica, esses conceitos correspondem à gravidade específica.
Isoladores, diferentemente dos condutores, não estão inclinados a perder elétrons. Neles, a ligação do elétron com o núcleo é muito forte e quase não há elétrons livres. Mais precisamente, mas muito poucos. Ao mesmo tempo, em alguns isoladores existem mais deles, e sua qualidade de isolamento é, consequentemente, pior. Basta comparar, por exemplo, cerâmica e papel. Portanto, os isoladores podem ser condicionalmente divididos em bons e ruins.
O aparecimento de cargas livres, mesmo nos isoladores, é devido às vibrações térmicas dos elétrons: sob a influência da alta temperatura, as propriedades isolantes se deterioram, alguns elétrons ainda conseguem romper com o núcleo.
Da mesma forma, a resistividade de um condutor ideal seria zero. Mas, felizmente, não existe esse condutor: imagine como seria a lei de Ohm (I = U / R) com zero no denominador! Adeus à matemática e à engenharia elétrica.
E somente a uma temperatura zero absoluta (-273,2 ° C) as flutuações térmicas param completamente e o pior isolador se torna bom o suficiente. Para determinar numericamente “isso” é ruim - use bem o conceito de resistividade. Esta é a resistência em Ohms de um cubo com um comprimento de borda de 1 cm, a dimensão da resistividade é obtida em ohms / cm. A resistência específica de algumas substâncias é mostrada abaixo.A condutividade é a recíproca da resistividade, é a unidade de medida da Siemens, - 1Sm = 1 / Ohm.
Eles têm boa condutividade ou baixa resistividade: prata 1,5 * 10 ^ (- 6), leia como (um a meio e dez à potência menos seis), cobre 1,78 * 10 ^ (- 6), alumínio 2,8 * 10 ^ (- 6). A condutividade de ligas com alta resistência é muito pior: constante em 0,5 * 10 ^ (- 4), nicrômio 1,1 * 10 ^ (- 4). Essas ligas podem ser chamadas de maus condutores. Depois de todos esses números complexos, substitua Ohm / cm.
Além disso, em um grupo separado, semicondutores podem ser distinguidos: germânio 60 Ohm / cm, silício 5000 Ohm / cm, selênio 100 000 Ohm / cm. A resistividade desse grupo é maior que a dos maus condutores, mas menor que a dos maus isoladores, sem mencionar os bons. Provavelmente, com o mesmo sucesso, os semicondutores poderiam ser chamados de semi-isoladores.
Após um conhecimento tão curto da estrutura e das propriedades de um átomo, deve-se considerar como os átomos interagem entre si, como os átomos interagem entre si, como as moléculas são feitas a partir das quais várias substâncias são compostas. Para fazer isso, você precisará novamente se lembrar dos elétrons na órbita externa do átomo. Afinal, são eles que participam da ligação dos átomos às moléculas e determinam as propriedades físicas e químicas da matéria.
Como os átomos são feitos dos átomos
Qualquer átomo está em um estado estável se houver 8 elétrons em sua órbita externa. Ele não procura pegar elétrons de átomos vizinhos, mas não desiste dos seus. Para verificar isso, é suficiente, na tabela periódica, observar os gases inertes: néon, argônio, criptônio, xenônio. Cada um deles tem 8 elétrons na órbita externa, o que explica a relutância desses gases em entrar em qualquer relação (reações químicas) com outros átomos, para construir moléculas de produtos químicos.
A situação é completamente diferente para os átomos que não possuem 8 elétrons estimados em sua órbita externa. Esses átomos preferem se unir aos outros para suplementar sua órbita externa com até 8 elétrons e encontrar um estado calmo e estável.
Por exemplo, a bem conhecida molécula de água H2O. Consiste em dois átomos de hidrogênio e um átomo de oxigênio, como mostrado na figura. 1.
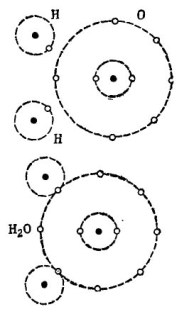
Desenhando 1. Como uma molécula de água é criada.
Na parte superior da figura, dois átomos de hidrogênio e um átomo de oxigênio são mostrados separadamente. Existem 6 elétrons na órbita externa de oxigênio e dois elétrons em dois átomos de hidrogênio estão próximos. O oxigênio até o estimado número 8 está faltando apenas dois elétrons na órbita externa, que ele receberá adicionando dois átomos de hidrogênio a si mesmo.
Cada átomo de hidrogênio carece de 7 elétrons em sua órbita externa para completa felicidade. O primeiro átomo de hidrogênio recebe em sua órbita externa 6 elétrons do oxigênio e outro elétron de seu gêmeo - o segundo átomo de hidrogênio. Agora existem 8 elétrons em sua órbita externa, juntamente com seu elétron. O segundo átomo de hidrogênio também completa sua órbita externa até o estimado número 8. Esse processo é mostrado na parte inferior da figura. 1.
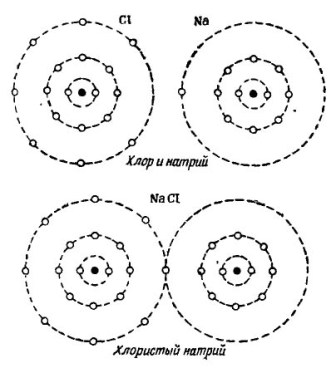
Na foto 2 O processo de combinação de átomos de sódio e cloro é mostrado. O resultado é cloreto de sódio, vendido em lojas chamadas sal.
Desenhando 2. O processo de combinação de átomos de sódio e cloro
Aqui, também, cada um dos participantes recebe do outro o número de elétrons que faltam: o cloro conecta um único elétron de sódio aos seus sete elétrons, enquanto dá seus átomos ao átomo de sódio. Ambos os átomos na órbita externa têm 8 elétrons, onde é alcançado o pleno acordo e prosperidade.
Valência dos átomos
Átomos com 6 ou 7 elétrons em sua órbita externa tendem a anexar 1 ou 2 elétrons a si mesmos. Dizem sobre tais átomos que são um ou divalentes. Mas se na órbita externa de um átomo 1, 2 ou 3 elétrons, esse átomo tende a denunciá-los. Nesse caso, o átomo é considerado um, dois ou trivalente.
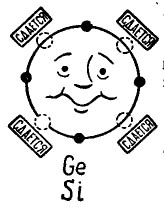
Se existem 4 elétrons na órbita externa de um átomo, esse átomo prefere combinar com o mesmo, que também possui 4 elétrons. É assim que os átomos de germânio e silício usados na produção de transistores se combinam. Nesse caso, os átomos são chamados tetravalentes. (Os átomos de germânio ou silício podem ser combinados com outros elementos, por exemplo, oxigênio ou hidrogênio, mas esses compostos não são interessantes no plano de nossa história.)
Na foto 3 é mostrado um átomo de germânio ou silício que deseja combinar com o mesmo átomo. Pequenos círculos pretos são os próprios elétrons do átomo, e os círculos de luz indicam os lugares onde os elétrons dos quatro átomos - vizinhos - caem.
Desenhando 3. Átomo de germânio (silício).
A estrutura cristalina dos semicondutores
Os átomos de germânio e silício na tabela periódica estão no mesmo grupo que o carbono (a fórmula química do diamante C é simplesmente cristais de carbono grandes obtidos sob certas condições) e, portanto, quando combinados, formam uma estrutura cristalina semelhante ao diamante. A formação dessa estrutura é mostrada, de forma simplificada, é claro, na figura 4.
Desenhando 4.
No centro do cubo há um átomo de germânio e mais 4 átomos estão localizados nos cantos. O átomo representado no centro do cubo é ligado por seus elétrons de valência aos vizinhos mais próximos. Por sua vez, os átomos angulares dão seus elétrons de valência ao átomo localizado no centro do cubo e seus vizinhos - átomos não mostrados na figura. Assim, as órbitas externas são suplementadas por até oito elétrons. Obviamente, não há cubo na estrutura cristalina, é apenas mostrado na figura para que o arranjo volumétrico e mútuo dos átomos seja claro.
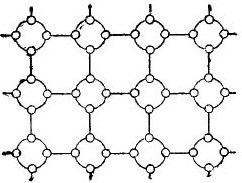
Mas, para simplificar o máximo possível a história sobre semicondutores, a estrutura cristalina pode ser descrita como um desenho esquemático, apesar do fato de que as ligações interatômicas estão localizadas no espaço. Esse circuito é mostrado na figura. 5.
Desenhando 5. A estrutura de cristal de germânio em uma forma plana.
Nesse cristal, todos os elétrons estão fortemente ligados aos átomos por suas ligações de valência; portanto, aparentemente, simplesmente não há elétrons livres aqui. Acontece que na nossa frente há um isolador na figura, pois não há elétrons livres nele. Mas, de fato, não é assim.
Condutividade intrínseca
O fato é que, sob a influência da temperatura, alguns elétrons ainda conseguem romper com seus átomos e, por algum tempo, se libertam da ligação com o núcleo. Portanto, existe uma pequena quantidade de elétrons livres em um cristal de germânio, devido à qual é possível conduzir uma corrente elétrica. Quantos elétrons livres existem em um cristal de germânio em condições normais?
Não existem mais do que dois elétrons livres por 10 ^ 10 (dez bilhões) de átomos; portanto, o germânio é um mau condutor ou, como é habitual, um semicondutor. Note-se que apenas um grama de germânio contém 10 ^ 22 (dez bilhões de bilhões de bilhões) de átomos, o que permite "obter" cerca de dois bilhões de bilhões de elétrons livres. Parece que o suficiente para passar uma grande corrente elétrica. Para lidar com esse problema, basta lembrar que corrente de 1 A.
Uma corrente de 1 A corresponde a passar através de um condutor em um segundo uma carga elétrica de 1 Coulomb, ou 6 * 10 ^ 18 (seis bilhões de bilhões) de elétrons por segundo. Nesse contexto, é improvável que dois mil bilhões de elétrons livres, e mesmo espalhados por um imenso cristal, garantam a passagem de altas correntes. Embora, devido ao movimento térmico, exista pequena condutividade na Alemanha. Essa é a chamada condutividade intrínseca.
Condutividade eletrônica e de furo
À medida que a temperatura aumenta, energia adicional é transferida para os elétrons, suas vibrações térmicas se tornam mais energéticas, como resultado dos quais alguns elétrons conseguem romper com seus átomos.Esses elétrons se tornam livres e, na ausência de um campo elétrico externo, fazem movimentos aleatórios e se movem no espaço livre.
Os átomos que perderam elétrons não podem fazer movimentos aleatórios, mas apenas oscilam ligeiramente em relação à sua posição normal na rede cristalina. Tais átomos, que perderam elétrons, são chamados de íons positivos. Podemos assumir que, no lugar de elétrons arrancados de seus átomos, são obtidos espaços livres, geralmente chamados de buracos.
Em geral, o número de elétrons e buracos é o mesmo; portanto, um buraco pode capturar um elétron que está próximo. Como resultado, um átomo de um íon positivo novamente se torna neutro. O processo de combinar elétrons com orifícios é chamado de recombinação.
Na mesma frequência, os elétrons são separados dos átomos; portanto, em média, o número de elétrons e orifícios para um determinado semicondutor é igual a, é constante e depende das condições externas, especialmente da temperatura.
Se uma tensão for aplicada ao cristal semicondutor, o movimento do elétron será ordenado, uma corrente fluirá através do cristal devido à sua condutividade de elétrons e orifícios. Essa condutividade é chamada intrínseca, já foi mencionada um pouco mais.
Porém, os semicondutores em sua forma pura, com condutividade eletrônica e de furo, não são adequados para a fabricação de diodos, transistores e outros detalhes, pois a base desses dispositivos é a junção p-n (leia-se "pe-en").
Para obter essa transição, são necessários dois tipos de semicondutores, dois tipos de condutividade (p - positivo - positivo, furo) e (n - negativo - negativo, eletrônico). Esses tipos de semicondutores são obtidos por dopagem, adicionando impurezas a cristais puros de germânio ou silício.
Embora a quantidade de impurezas seja muito pequena, sua presença altera em grande parte as propriedades do semicondutor, permitindo obter semicondutores de condutividade diferente. Isso será discutido na próxima parte do artigo.
Boris Aladyshkin, https://ptv.electricianexp.com
Veja também em bgv.electricianexp.com
: